宾夕法尼亚大学佩雷尔曼医学院 Scheie 眼科研究所的研究人员称,患有儿童期失明遗传形式的成年人在接受实验性基因治疗后的几天内夜视能力显着恢复。
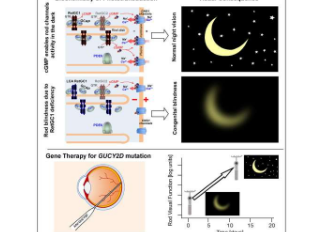
这些患者患有 Leber 先天性黑蒙 (LCA),这是一种由 GUCY2D 基因突变引起的先天性失明。研究人员的研究结果发表在iScience杂志上,他们根据临床试验方案,将携带健康基因 DNA 的 AAV 基因疗法输送到每位患者的一只眼睛的视网膜中。在接受治疗的几天内,每位患者在接受治疗的眼睛中都表现出由杆状感光细胞介导的视觉功能大幅增加。杆状细胞对光极为敏感,并占人类低光视觉能力的大部分。
“这些令人兴奋的结果表明,光转导的基本分子机制在某些 LCA 病例中基本保持完好,因此即使在数十年失明后也可以接受基因治疗,”研究的主要作者 Samuel G. Jacobson 医学博士说.,宾夕法尼亚大学眼科教授。
LCA 是最常见的先天性失明疾病之一,影响大约 40,000 名新生儿中的一名。一位 LCA 患者的视力丧失程度可能因另一位患者而异,但所有此类患者从生命的最初几个月开始就有严重的视力障碍。有超过两打基因的功能障碍会导致 LCA。
高达 20% 的 LCA 病例是由 GUCY2D 突变引起的,GUCY2D 是一种编码视网膜感光细胞所需的关键蛋白的基因,该蛋白用于“光转导级联”——将光转换为神经元信号的过程。先前的影像学研究表明,患有这种形式的 LCA 的患者往往具有相对保留的感光细胞,特别是在富含视杆的区域,这暗示如果存在功能性 GUCY2D,基于视杆的光转导可以再次起作用。去年报道的低剂量基因治疗的早期结果与这一想法一致。
研究人员在两名患者身上使用了更高剂量的基因疗法,一名 19 岁的男性和一名 32 岁的女性,他们有特别严重的视杆状视觉缺陷。在白天,患者的视觉功能虽然严重受损,但在夜间他们实际上是失明的,对光的敏感度比正常人低 10,000 到 100,000 倍。
研究人员只对每位患者的一只眼睛进行了治疗,因此可以将治疗后的眼睛与未治疗的眼睛进行比较,以评估治疗效果。视网膜手术由 Thomas Jefferson 大学和 Wills 眼科医院的眼科教授 Allen C. Ho 医学博士进行。测试表明,在这两名患者中,接受治疗的眼睛在弱光条件下的光敏感度提高了数千倍,大大纠正了原来的视觉缺陷。研究人员总共使用了九种互补的方法来测量患者的光敏感度和功能性视力。其中包括在弱光条件下测试房间导航技能和测试瞳孔对光的非自愿反应。测试始终显示基于视杆的低光视力有重大改进,
“同样惊人的是治疗后改善的速度。在八天内,两名患者都已经显示出可测量的疗效,”该研究的合著者、宾夕法尼亚大学眼科研究教授 Artur V. Cideciyan 博士说。
对研究人员来说,结果证实了 GUCY2D基因治疗可恢复基于视杆的光感受器功能,并表明具有更严重视杆功能障碍的 GUCY2D-LCA 患者可能从治疗中受益最大。实际信息是,在筛选 LCA 候选者和在整个治疗试验期间监测它们时,应该强调视杆视力测量。
研究人员说,研究结果还强调了一个显着的事实,即在一些患有严重先天性视力丧失的患者中,介导视力的视网膜细胞网络基本上保持活力和完整,只需补充缺失的蛋白质即可重新开始工作,更多或更少立即。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!
