杜克大学和阿尔伯特爱因斯坦医学院的生物医学和基因工程师设计了一种小型荧光蛋白,可以发射和吸收深入生物组织的光。这种蛋白质针对近红外 (NIR) 光谱中的波长量身定制,可以帮助研究人员捕获更深入、更清洁、更精确的生物医学图像。
这项工作于 12 月 1 日发表在《自然方法》杂志上。
用光对深层组织成像具有挑战性。可见光通常会被体内的结构和分子迅速吸收和散射,从而使研究人员无法看到组织内超过一毫米的深度。如果他们设法进一步探测,胶原蛋白或黑色素等物质通常会使图像变得模糊,通过它们的自然荧光产生相当于背景噪音的物质。
杜克大学生物医学工程助理教授 Junjie Yao 说:“生物分子自然地吸收和发射可见光谱中的光,大约在 350 到 700 纳米之间。” “因此,当使用它对深层组织成像时,就像试图在白天观察星星一样。信号被淹没了。”
为了走出这些浑水,Yao 和他的合作者、纽约阿尔伯特爱因斯坦医学院遗传学教授 Vladislav Verkhusha 开发了一种蛋白质,它可以吸收和发射近红外 (NIR) 光谱中更长波长的光。
“在近红外光的 700-1300 纳米窗口中,组织是最透明的,”姚说。“在这些波长下,光可以更深入地穿透组织,而且由于过滤掉的自然背景荧光较少,我们可以进行更长时间的曝光并捕获更清晰的图像。”
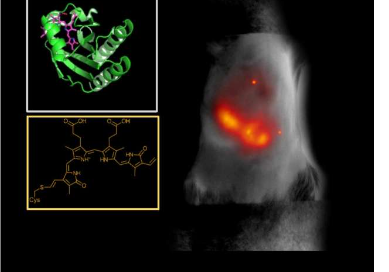
Verkhusha 和他的实验室使用一种称为定向分子进化的过程来设计他们的蛋白质,使用通常在细菌中发现的光感受器作为结构的基础。这些感光器对成像研究很有用,因为当受到特定波长的光照射时,它们可以在静默和活跃状态之间切换。它们可以与胆绿素结合,胆绿素是一种在哺乳动物和人体组织中大量出现的生物分子。
“我们研究了胆绿素的结构,以确定光感受器如何最好地附着在生物分子上,”Verkhusha 解释说。“在我们了解了结合过程之后,我们小心地引入了与胆绿素相连的分子关键部分的替代,以增加电子结合,这是获得红移荧光所必需的。最后,我们进行了随机诱变,然后进行了高通量分析放映,这样蛋白质就会进化并增加它们的亮度。”
发现的最亮的蛋白质,称为 miRFP718nano,很容易在细胞和组织中产生,并发出可见光范围之外的光。但是,虽然 NIR 激活本身是有帮助的,但在最初的活性爆发之后发生的事情对生物医学成像更有希望。
“我们已经看到 NIR 范围可以分为两个主要区域,”Yao 解释道。“当 NIR 光第一次击中这些蛋白质时,它们在第一个区域发光,大约 700-900 纳米。但随着它们衰减,波长逐渐变长,就像彗星后面的尾巴一样。那时它们开始发光在第二个 NIR 区域,即 900-1300 纳米。”
在第二个区域,使用较短波长的区域一近红外光的所有好处都得到了增强:光可以穿透组织两倍的深度,背景荧光显着变暗,图像分辨率可以清晰两到三倍,从而获得详细的图像复杂的结构。
作为概念验证,Yao 和他在杜克大学的团队使用一种称为短波红外 (SWIR) 的成像技术来测试新蛋白质的功效。这个过程将 NIR 区域一光发送到组织深处以激活荧光蛋白。随着蛋白质的衰变,它们会发出近红外二区光,提供有关目标组织和细胞的结构和组成的信息,这些信息可以转化为高分辨率图像。
标签:
免责声明:本文由用户上传,如有侵权请联系删除!
