科学家们发现了一种机制,通过该机制,蛋白质的一个区域发生形状变化,将维生素 A 转化为眼睛的感光细胞可以使用的形式。当它遇到细胞内膜或围绕细胞不同部分的薄结构时,称为 RPE65 的蛋白质先前未表征的区域会自发地变成螺旋形。
这种变形使 RPE65 能够进入内质网——一个由囊状结构和管组成的网络——在那里 RPE65 执行维生素 A 转化的关键任务。科学家们表示,这一发现提供了对 RPE65 功能的更好理解,并将为与 RPE65 基因突变相关的视力障碍提供潜在的治疗方法。隶属于国立卫生研究院的国家眼科研究所的研究人员进行了这项研究,该研究发表在Life Science Alliance上。
当光线照射到称为视蛋白的感光色素时,就会出现视觉,触发一系列化学反应,从而向大脑产生信号。视网膜色素上皮 (RPE) 是光感受器旁边的支持组织,它为视蛋白充电以恢复其对光的敏感性。在一个称为视觉周期的过程中,RPE65 对于将用过的维生素 A 衍生物全反式视黄醇转化回光敏 11-顺式视黄醛至关重要。RPE65 基因的突变与早发性严重致盲疾病有关。
RPE65 与 RPE 细胞内质网的相互作用对于制造 11-顺式视黄醛至关重要,但 RPE65 与内质网膜结合的机制至今仍是个谜。
T. Michael Redmond 博士和 NEI 视网膜细胞和分子生物学实验室的科学家们在新研究中展示了 RPE65 如何进入 RPE 细胞的内质网膜,其中涉及 RPE65 的转化过程。
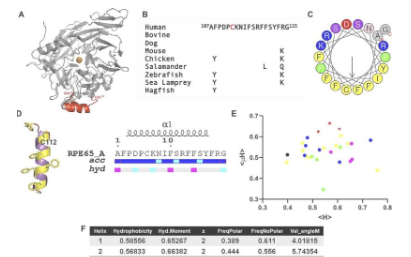
“我们使用晶体学等方法来可视化晶体形式的蛋白质原子,但未能为我们提供缺少这个关键区域的 RPE 结构的完整图景,”Sheetal Uppal 博士说。 NEI 和该研究的第一作者。“我们不得不想出一种新的策略来表征 RPE65 结构的这一方面,所以我们转向了生物化学。”
NEI 团队发现,在水溶液中,RPE65 的特定区域缺乏结构,但当它遇到膜时,它会自发形成两亲性 α-螺旋——蛋白质中的一种特殊螺旋形状。这种变化使 RPE65 能够与 RPE 细胞的内质网膜结合,其中 11-顺式视黄醛由全反式视黄醇产生。
更重要的是,当 RPE65 先前未表征的区域内的单个特定氨基酸被特定脂质修饰时,它大大加快了 α-螺旋的形成,将其“锁定”到位,并促进其插入细胞膜. 据 Uppal 说,这是以前在蛋白质中从未见过的东西。
分子动力学模拟的计算机建模支持他们的结果。研究人员总结道:“我们的发现解决了 RPE65 结构中长期存在的难题,阐明了它的功能,同时以我们希望以更准确的方式为疾病模型提供信息的方式扩展了我们对膜结合的了解。”
标签:
免责声明:本文由用户上传,如有侵权请联系删除!
